
מחלה תורשתית נדירה בשם LAD-1 גורמת לכך שתאי מערכת החיסון של החולים לא יכולים לצאת ממחזור הדם אל הרקמות ולהתמודד עם זיהומים שחדרו לגופם. לכן למרבה הצער מרבית הפעוטות החולים לא מגיעים לגיל שנתיים. ריפוי גני חדשני שמבוסס על הבנה מדעית מעמיקה של המחלה מספק לילדים תקווה לחיים בריאים ומלאים.
פרסומת
מחלות תורשתיות נדירות, כאלה הפוגעות ביילוד אחד למיליון, מעמידות אתגר מיוחד בפני מטופלים ומשפחותיהם בשל דלות המידע והמחקר עליהן. המחלות האלו, המכונות "מחלות יתומות" אינן זוכות לתשומת לב ממערכות הבריאות וחברות התרופות הגדולות.
למרות זאת, חברות ביוטק קטנות, במיוחד בתחום הטיפול הגני, דווקא ״מאמצות״ מחלות יתומות ואת קהילות המטופלים שלהן. בין היתר משום שטיפול למחלה נדירה שאין לה תרופה יכול לקבל אישור בהליך מזורז ברשויות הרגולטוריות ולתת לחברה הצעירה הישג ראשוני. מסיבה זו, אנחנו רואים בשנים האחרונות לא מעט חברות שמפתחות טיפולים גניים דווקא למחלות נדירות. מטרתם של טיפולים אלה לתקן פגמים גנטיים שגורמים למחלות התורשתיות, והם מעוררים תקווה חדשה, ולעיתים יחידה, לחולים במחלות יתומות ולמשפחותיהם.
אחת המחלות האלו היא leukocyte adhesion deficiency מסוג 1 ובקצרה LAD-1 שמאופיינת בחוסר יכולת של תאי מערכת החיסון להתמודד עם זיהומים. המחלה נגרמת ממוטציות בגן ITGB2, שמכיל את ההוראות לייצור חלבון מסוג אינטגרין שעל תפקידו החשוב נספר לכם בהמשך [1-3].
על מנת להגן על גופנו מזיהומים שנגרמים, למשל, מחיידקים או נגיפים, תאי הדם הלבנים צריכים להגיע בזמן הנכון לרקמה המותקפת ולחסל את הפולשים. בעזרת זרם הדם הם יכולים לנוע ממקום למקום, אבל שיט חסר מטרה וכיוון לא ישיג את היעד, התאים צריכים לצאת מכלי הדם במיקום המדויק שיאפשר להם להגיע במהירות לרקמה שנמצאת בצרה ו"קוראת לעזרה".
התהליך המרשים הזה קורה במספר שלבים: תחילה, בעקבות שינויים במאפיינים של כלי הדם בסביבת הרקמה המותקפת, תא הדם הלבן מאט ונצמד לדופן. כאשר הוא מזהה מולקולות שמופרשות מאזור הזיהום, אותם חלבוני אינטגרינים שנמצאים על פניו ומתפקדים כזרועות, מופעלים ונדבקים לקולטנים שנמצאים על התאים בדופן כלי הדם. עכשיו, לאחר שנדבק באזור הרצוי, כל שנותר לתא הלבן לעשות הוא להשתחל החוצה מתוך כלי הדם אל הרקמה המותקפת.
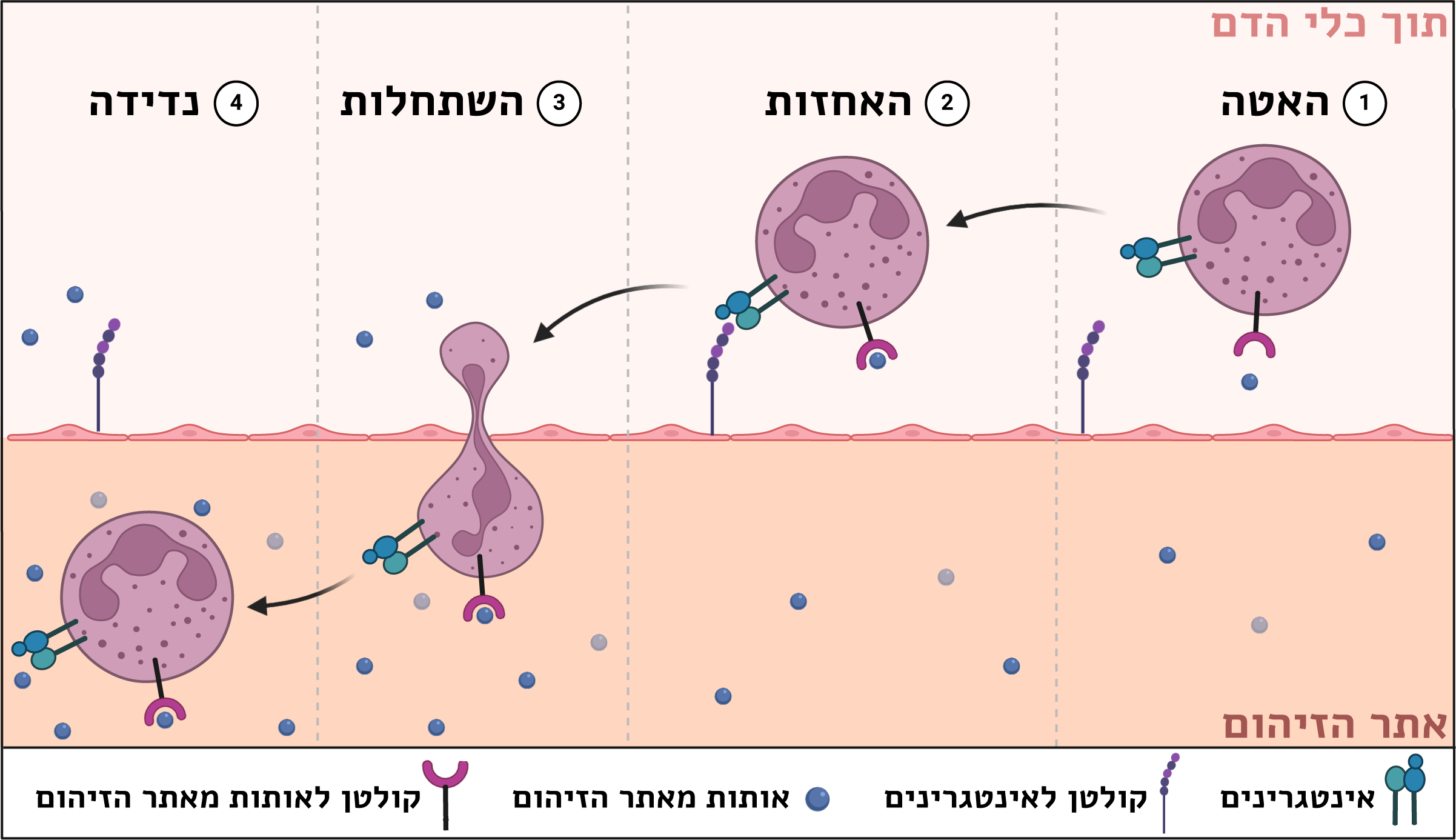
שלבי היציאה של תאי מערכת החיסון מכלי הדם לעבר אתר הזיהום | איור: עלי שמשוני באמצעות BioRender.com
בדיקת דם פשוטה של חולה ב־LAD-1 מרמזת על הגורם לבעיה: בפעוטות אלו רואים עודף עצום של תאי דם לבנים במחזור הדם. החסר באינטגרין גורם לכך שהתאים הלבנים כלואים בכלי הדם ולא יכולים להגיע למקום שבו הם נחוצים. אחד מהסימנים הבולטים של המחלה הוא פצעים וחתכים שאינם מגלידים כראוי והם מאופיינים בכך שלא נוצרת בסביבתם מוגלה, תהליך טבעי ורצוי שבו תאי דם לבנים מסוג נויטרופילים מגיעים לתקוף את מחוללי המחלה.
בגלל החוסר באינטגרין הפעוטות החולים מפתחים לא מעט זיהומים קשים באזורים רבים בגוף, כמו המוח, דרכי הנשימה התחתונות והחניכיים, ומבלים את רוב ינקותם באשפוזים חוזרים. השלכות המחלה עגומות: מעל 60% מהפעוטות החולים מתים טרם הגיעם לגיל שנתיים.
עד כה, הפתרון היחיד שיכול להציל את הילדים היה השתלה של מח עצם מתורם. מח העצם מכיל תאי גזע של הדם שמהם יכולים להיווצר כל סוגי תאי הדם, כולל תאי מערכת החיסון. השתלת מח עצם מוצלחת פירושה שתאי הגזע של התורם מתיישבים במח העצם של המטופל, מתרבים ומתפתחים, ובתוך כמה חודשים מערכת החיסון של התורם מתפשטת בגוף החולה ומחליפה את מערכת החיסון שהייתה לו.
המכשול הראשוני הוא מציאת תורם מתאים כך שיפחת הסיכון לכך שתאי מערכת החיסון מהתורם יתקפו את הגוף של החולה, מה שמכונה "מחלת השתל נגד המאכסן" שהיא תופעה מסכנת חיים. אם התמזל מזלו של החולה ונמצא עבורו תורם מתאים, ניתן להתחיל בתהליך. במקרה של LAD-1, רק 58% מהילדים שעברו השתלת מח עצם מתורם עברו את שלוש השנים שלאחריה ללא סיבוכים.
מחקר קליני חדש הדגים טיפול בתשעה ילדים חולים בגישה חדשנית: החדרת עותק תקין של הגן הפגום לתאי הגזע של מערכת הדם של החולים עצמם [4-5]. לא רק שגישה זו חוסכת את הצורך במציאת תורם מתאים גנטית – מה שמרוויח לחולים זמן יקר, אלא היא גם מבטלת את הסיכון למחלת השתל נגד המאכסן.
תחילה, נשאבו תאי גזע ממח העצם של הפעוטות החולים. בשלב הבא, החוקרים החדירו לתאים נגיף מהונדס גנטית, שבתורו החדיר לתוך הגנום של התאים עותק תקין של הגן לאינטגרין. כדי למנוע פעילות לא רצויה של הנגיף הוא הונדס כך שלא יוכל להמשיך להשתכפל ולהדביק תאים נוספים.
בדומה להשתלת מח עצם מתורם, כדי לאפשר לתאים המתוקנים להפוך להיות מערכת החיסון החדשה של המטופל, נותנים לו כימותרפיה שתפקידה להכחיד את תאי הגזע של מערכת הדם שלו. רק לאחר מכן, מחזירים לחולה בעירוי את התאים המהונדסים שמהווים את הבסיס למערכת החיסון החדשה שלו.
תוצאות הניסוי היו מרשימות במיוחד, כל תשעת הילדים שהשתתפו במחקר שרדו, וכולם קיבלו את הטיפול לפני שנתיים לפחות [4]. לא רק זאת, אלא שנצפתה ירידה דרמטית של כ־85% בזיהומים חמורים המצריכים אשפוז או טיפול תוך־ורידי. בנוסף, פצעים, כיבים וחתכים שהתינוקות סבלו מהם החלו להחלים בצורה תקינה לאחר הטיפול.
כל תופעות הלוואי שדווחו היו קשורות למתן הכימותרפיה טרם החזרת התאים המהונדסים לגוף המטופלים ולא לטיפול עצמו. חשוב לציין כי למרות הפרופיל הבטיחותי הטוב שהמחקר הראה, בטיפולים גניים מסוג זה הגן התקין מוחדר באקראיות לגנום של תאי מח העצם של המטופל, ולכן קיימת סכנה שההחדרה תקרה באזורים בעייתיים, מה שעלול לגרום להתפתחות של סרטן. החוקרים לא מצאו עדות לכך באף אחד מהמטופלים, אך אין זה אומר שתקלה כזו לא תתרחש בעתיד במטופלים אחרים.
הטיפול, שהוגש לאישור של מנהל המזון והתרופות האמריקאי (FDA), צירף את LAD-1 למספר מצומצם של מחלות דם תורשתיות קטלניות שהפכו בנות ריפוי בזכות ההתקדמות האנושית המדהימה בתחום הביולוגיה והרפואה [6-7]. כדי להציל את הפעוטות הללו, נדרש שילוב של הבנה מעמיקה של המחלה, הן ברמה הגנטית והן ברמה הקלינית, יחד עם טכנולוגיות מולקולריות מתקדמות שמאפשרות החדרת עותק תקין של הגן הפגום והחזרת התאים המתוקנים לגופו של המטופל בבטחה. טיפולים מסוג זה, שכאמור יכולים לקבל אישור בהליך מזורז יחסית, מעניקים תקווה למשפחות רבות המייחלות לפתרון דומה עבור ילדיהן שסובלים ממחלות יתומות.
בתמונה הראשית: שלושה אחים עם LAD-1 שטופלו בהצלחה בטיפול הגני | באדיבות המשפחה ואוניברסיטת קליפורניה בלוס אנג׳לס
עריכה: גליה הלוי שדה
מקורות
- הסבר על המחלה מאתר למען חולים בכשל חיסוני
- מאמר סקירה על המחלה
- מאמר סקירה נוסף על המחלה
- המאמר המקורי שמתאר את הניסוי הקליני בריפוי גני לחולי LAD-1
- אתר החברה שמייצרת את הטיפול הגני
- סיפורם של שלושה אחים שטופלו בריפוי הגני
- ריפוי גני לילדי הבועה
- הטיפול הראשון שמבוסס על עריכה גנטית באמצעות קריספר אושר לשימוש בחולי אנמיה חרמשית ובטא תלסמיה









