
הדפסת תלת־ממד ביולוגית (Bioprinting) מציינת מהפכה בתחום הרפואה המותאמת אישית, עם פוטנציאל לשנות את פני התחום. הטכנולוגיה מאפשרת ייצור מדויק של שתלים, רקמות ואף איברים שלמים, בהתאמה אישית למטופל – מקרניות לעיניים ועד יריעות של עור ולב.
פרסומת
סרטון בקטנה
תקציר לכתבה ונקודות מרכזיות כאן:
המחסור הכרוני באיברים להשתלה ובעיות של חוסר התאמה בין רקמת התורם לחולה מהווים עדיין אתגר מרכזי ברפואה. בשנים האחרונות, טכנולוגיות חדשניות מקרבות אותנו למטרה הנכספת של "חלקי חילוף" מותאמים אישית למטופל. למשל, הדפסת תלת־ממד, תהליך שבו חומרים מודפסים שכבה אחר שכבה ליצירת מבנים תלת־ממדיים מדויקים, מציעה מענה מבטיח לאתגרים אלה. טכנולוגיה זו מאפשרת ייצור שתלים, פרוטזות ואף רקמות חיות [1] אשר עונים על דרישות מכניות ספציפיות ומותאמים אישית, ומסייעת להתגבר על מגבלות כמו דחייה חיסונית או חוסר התאמה אנטומית.
אחד היישומים המרכזיים והוותיקים של הדפסת תלת־ממד ברפואה הוא ייצור פרוטזות ושתלים מותאמים אישית. במקרה של פרוטזות – תותבות חיצוניות המחליפות או משלימות חלקי גוף חסרים – ניתן להשתמש בסריקות תלת־ממד של גוף המטופל כדי לייצר תותבות מדויקות, הן מבחינת מידה והן מבחינת עיצוב. ארגונים כמו Enabling the Future [2] מייצרים ידיים תותבות זולות ונגישות בהתאמה אישית של גודל וצורה. במקרה של שתלים המוחדרים לתוך הגוף, לדוגמה שתלי גולגולת או פנים, משתמשים בחומרים בעלי תאימות ביולוגית דוגמת טיטניום או פולימרים ייחודיים כדי לאפשר לשתל להשתלב היטב בגוף ולמנוע תגובה של מערכת החיסון. ההדפסה מאפשרת התאמה מדויקת למבנה האנטומי של המטופל, מה שתורם להצלחת הטיפול הן מבחינה רפואית והן מבחינה אסתטית.
לעומת פרוטזות ושתלים, שתכנונם מתמקד בהתאמה אנטומית ועמידות מכנית, האתגר הגדול בהדפסת תלת־ממד של רקמות חיות לשימוש קליני בבני אדם, המודפסות מתאים אנושיים ופיגומים ביולוגיים, הוא שמירה על חיוניות התאים ושילוב הרקמה במערכות הגוף. דרישות אלו מחייבות שליטה מורכבת בתנאי הדפסה, תזונה תאית ואינטגרציה עם כלי דם.
דוגמה מובילה בתחום זה היא עבודתה של חברת הטכנולוגיה הישראלית פרסייס ביו (Precise Bio), המקימה בימים אלו קו ייצור להדפסת תלת־ממד של קרניות כדי להתחיל ניסויים קליניים בבני אדם במרכז הרפואי שיבא [3]. עיוורון קרנית הוא מחלה שבה הקרנית הופכת דקה ומשנה צורתה מכיפתית לחרוטית, מה שמונע מקרני האור להתמקד כראוי בעין. מחלה זו היא גורם מוביל לאובדן ראייה ברחבי העולם, ומצריכה לעיתים קרובות השתלת קרנית. המחסור בתרומות קרנית הוביל לפיתוח קרניות מלאכותיות המיוצרות בהדפסת תלת־ממד. החברה משתמשת בטכנולוגיה של הדפסת תלת־ממד לייצור שתלים של תאי אנדותל אנושיים צפופים (תאי אנדותל הם תאים המצפים את פנים כלי הדם), הנתמכים בפיגום מבוסס קולגן אנושי [4]. במהלך ההדפסה יוצרים מהקולגן מבנים אשר ינחו את היווצרותן של רקמות תלת־ממדיות מתאים שיגדלו על גבי הקולגן ויתמכו ברקמות אלו [1] [5]. פיגום הקולגן האנושי מתוכנן להיות בעובי של כמה מיקרונים, כדי לאפשר מניפולציה קלה במהלך ניתוח ההשתלה. בתהליך יצירת הקרנית, תאי אנדותל קרנית (CECs) מבודדים מקרנית של תורם ומגודלים בתנאי מעבדה עד שהם מתחלקים למספר גדול יותר של תאים. תאי הקרנית משמשים להדפסה של שכבה חד־תאית על פיגום הקולגן, תהליך המבטיח פיזור אחיד וצפיפות גבוהה של התאים, החיוניים לקליטה מוצלחת של השתל. במהלך הניתוח, השתל המודפס נטען במזרק זכוכית ומוחדר לעין המטופל דרך חתך קטן [6].
החברה כבר ערכה ניסוי טרום־קליני בארנבות, שעבר בהצלחה, אך כדי להתקדם לניסויי השתלה בבני אדם יש צורך לעמוד בדרישות הרגולטוריות שהציב ה־FDA (מינהל המזון והתרופות האמריקאי). נדרשת הוכחה שהרקמה המיוצרת במעבדה מתפקדת באופן זהה לרקמה אנושית טבעית – כולל שקיפותה, תכונותיה המכניות ויציבות התאים לאורך זמן. הבחירה להתחיל דווקא בהדפסת קרנית נובעת מהמאפיינים הייחודיים של הרקמה: היא אינה דורשת התאמה אישית למושתל, כי כמעט ואינה מעוררת תגובה חיסונית. עם זאת, החברה מתכננת להרחיב את הפיתוח גם לתחומים נוספים כמו אורתופדיה וקרדיולוגיה, ומקווה אף להגיע ליעד שאפתני יותר בעתיד: הדפסת כליה שלמה מתאי המטופל, מהלך שיבטל את הצורך בתרופות נוגדות דחייה לאחר השתלה.
הדפסת תלת־ממד של רקמות מורכבות יותר, כמו עור ושריר לב, נמצאת אף היא בהתפתחות מואצת. בתחום רפואת העור, טכנולוגיות הדפסה ביולוגית מאפשרות ייצור שכבות עור לטיפול בכוויות ופצעים כרוניים. הטכנולוגיה מאפשרת התאמה אישית של הרקמה למטופל, עם פוטנציאל להפחתת הסיכון לדחייה ולשיפור תהליך ההחלמה. מחקרים מצביעים על אפשרות לייצר עור הכולל מבנים מורכבים כמו זקיקי שיער וכלי דם, מה שמקרב את האפשרות לשימוש קליני נרחב [7].
השתלת לב היא עדיין הטיפול העיקרי לאי־ספיקת לב סופנית, אך מחסור בתורמים וסיכונים של דחייה, זיהומים וסיבוכים נוספים מגבילים את יעילותה. הדפסה ביולוגית של רקמות לב המבוססות על תאים שמקורם במטופל עצמו מציעה פתרון פוטנציאלי שעוקף בעיות של תאימות חיסונית ומחסור באיברים. שימוש בתאי גזע מושרים (iPSCs), תאים בוגרים שתוכנתו חזרה למצב דמוי עוברי והם מהווים מקור בלתי מוגבל של תאים מכל סוג [8], מאפשר יצירת רקמות לב מתפקדות, שבאמצעותן ניתן לטפל באי־ספיקת לב ובמומים מולדים. עם זאת, עדיין קיימות מגבלות טכנולוגיות שצריך להתגבר עליהן, לדוגמה קושי בהדפסת רקמות עבות וצפיפות תאים נמוכה יחסית [9].
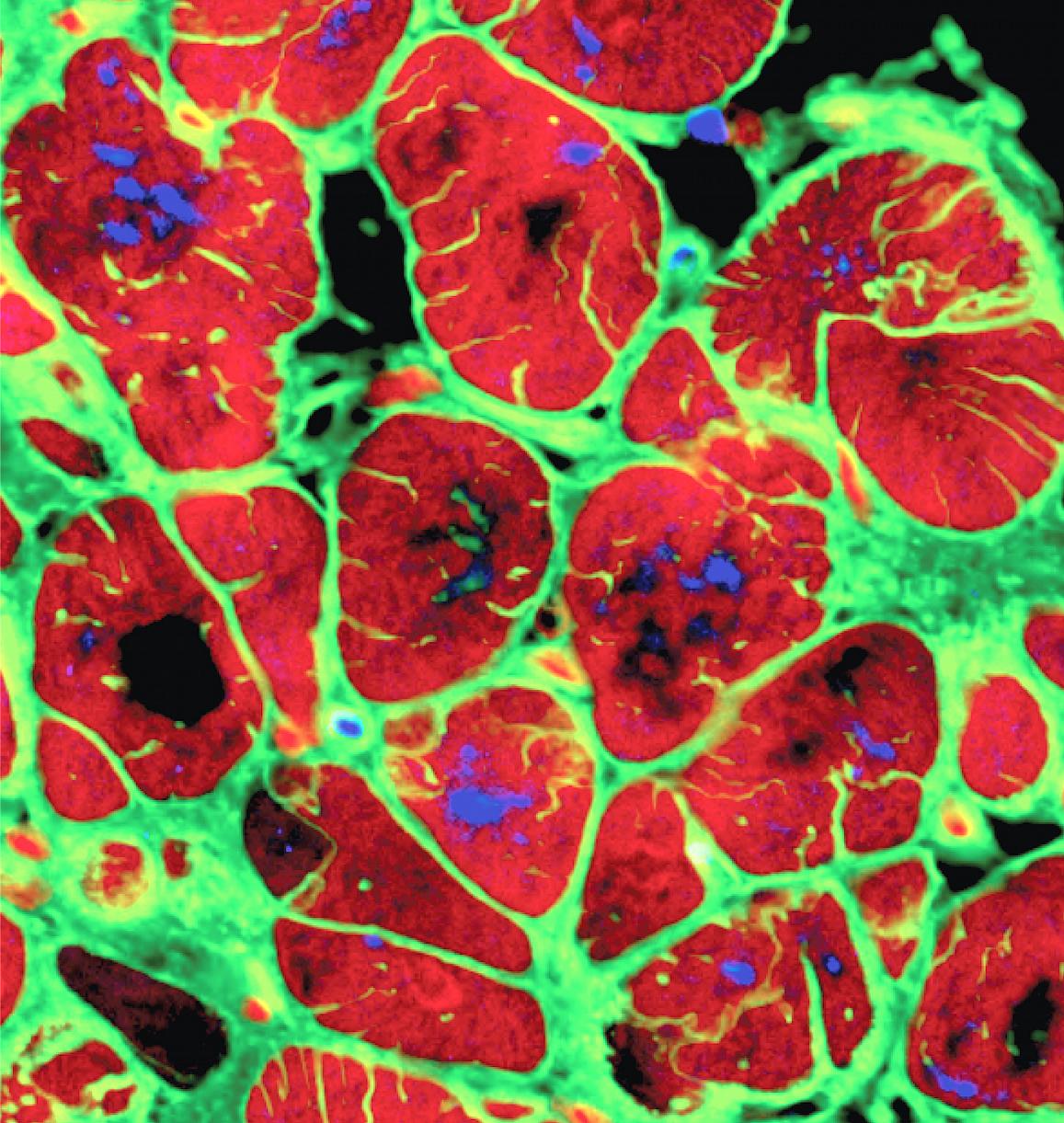
תאי שריר לב שגודלו מתוך תאי גזע מושרים Image_ Columbia University via NIBIB
עדיין קיימים אתגרים משמעותיים – בהם עלויות גבוהות, רגולציה מורכבת, וכן הצורך בשיפור ההתאמה של הרקמות המודפסות ויכולת הדפסת של רקמות מורכבות, הכוללות תאים מסוגים שונים וכלי דם המזינים אותן. לעיתים קרובות תהליך ההדפסה אינו מאפשר יצירת מבנים תלת־ממדיים מורכבים ברזולוציה גבוהה. לפיכך, עתיד ההדפסה הביולוגית תלוי בשיפור טכניקות ההדפסה ובבחירה וגיבוש של חומרים ביולוגיים מתאימים לבניית רקמות ואיברים. גישה רב־תחומית המשלבת דיסציפלינות משלימות כמו הנדסת חומרים, ביו־הנדסה וביולוגיה [10] תביא אותנו לעתיד שבו הדפסת תלת־ממד תאפשר ייצור של איברים שלמים להשתלה, בהתאמה אישית מלאה למטופל.
עריכה: סמדר רבן
מקורות והרחבות
[1] הדפסת לב קטן תואם למטופל באוניברסיטת תל אביב
[3] כתבה ב"דה מרקר" על חברת פרסייס ביו
[4] על חלבון הקולגן
[6] מאמר על הדפסת תלת-ממד של קרניות
[7] מאמר סקירה על הדפסת תלת מימד של עור
[8] על תאי גזע
[9] מאמר סקירה על פיתוחים בהדפסת תלת-ממד בתחום הקרדיו וסקולרי








